水溶液の種類3つ・特徴3つ・蒸発させると?速くとかす方法3つ
水溶液(酸性・中性・アルカリ性)と指示薬(リトマス紙・BTB・フェノールフタレイン)覚え方・語呂合わせ
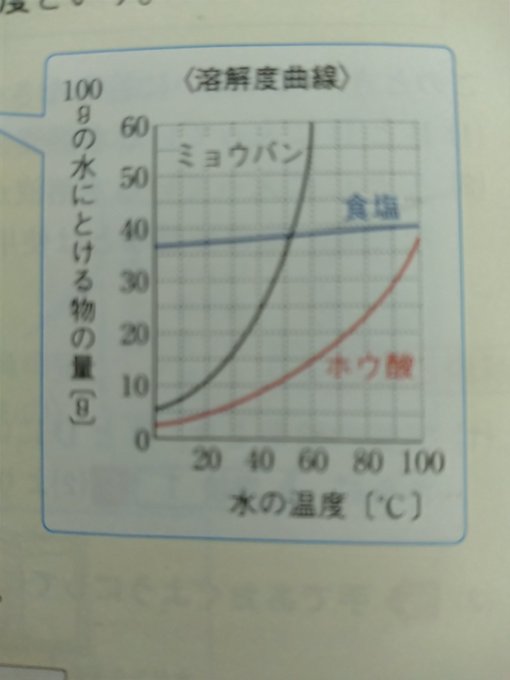
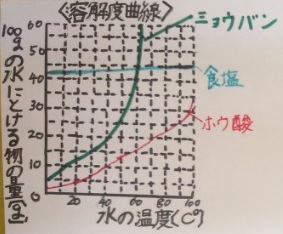
溶解度:ある物が水100gに溶ける最大の量を重さ(g)で表したもの

溶解度:ある物が水100gに溶ける最大の量を重さ(g)で表したもの
●固体(の多く)は水の温度が高くなると溶解度が大きくなる
例外:食塩は水温が上がっても溶解度はあまり変わらない
例外:水酸化カルシウム(消石灰)は水温が上がると溶解度が小さくなる
●水の温度が同じなら水の量が多くなると溶解度も大きくなる
●気体は(普通)水の温度が高くなるほど溶解度は小さくなる

つまり、水の温度が高く、水がたくさんある方が、物はよく水に
溶けるという事ですね。
ただし、気体(塩化水素とか)は逆で、水の温度が上がると、溶け
にくくなるということです。
(同じグラフに、逆向き(温度が上がるほど溶解度が下がる)の
ものがあったら、それが気体である可能性が高いです)

溶解度に関しては、【食塩】【ミョウバン】【ホウ酸】のグラフ
がよく出題されます。
それ以外に【砂糖】などもあります。下図は砂糖の溶解度の表です。
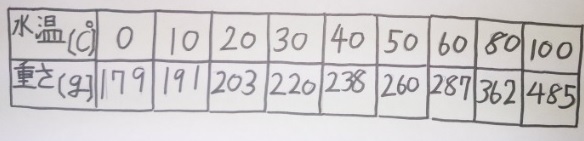
この表を見て、80℃の水40gに溶ける砂糖の量を求めなさい。
(溶解度:ある物が水100gに溶ける最大の量を重さ(g)で表したものなので)
40gは100gの40/100=2/5倍。
362×2/5=144.8
答え)144.8g
再結晶:固体が溶けた水溶液から元の固体が再び結晶となって出てくる現象
再結晶:固体が溶けた水溶液から元の固体が再び結晶となって出てくる現象
再結晶の方法は2つあります。
1:水溶液の温度を下げる(水温で溶解度が大きく変わるもの。ホウ酸、ミョウバン)
2:水溶液を加熱して水を蒸発させる(水温で溶解度が変わらないもの。食塩)
「再結晶」は、不純物を含むものから純粋な物を取り出したい時などに利用できます。
例えば、少量の食塩を含むホウ酸がある場合、温度の高い水に溶かしてから、
水の温度を下げると、(水温の影響が少ない)食塩は水に溶けたままですが、
ホウ酸は再結晶して出てきます。
「水溶液を冷やした時に出てくる結晶の量」
=溶かしたものの重さ-冷やした温度での溶解度
結晶の形:食塩、ミョウバン、ホウ酸、硝酸カリウム
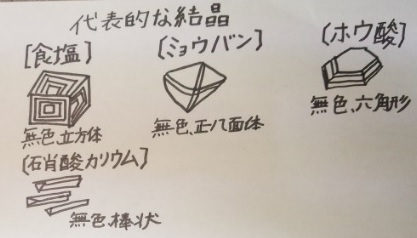
【結晶の形:食塩、ミョウバン、ホウ酸、硝酸カリウム】
結晶の形は物の種類によって決まっているので、再結晶で結晶が
出てきた場合、何が水溶液に溶けていたかが分かります。
水溶液の種類3つ・特徴3つ・蒸発させると?速くとかす方法3つ
水溶液(酸性・中性・アルカリ性)と指示薬(リトマス紙・BTB・フェノールフタレイン)覚え方・語呂合わせ