水溶液の種類3つ・特徴3つ・蒸発させると?速くとかす方法3つ
水溶液(酸性・中性・アルカリ性)と指示薬(リトマス紙・BTB・フェノールフタレイン)覚え方・語呂合わせ
中和の問題パターン2つ!完全中和点を探す系の問題は「逆比」で解く
中和とは?
酸性の水溶液(塩酸、炭酸水etc.)とアルカリ性の水溶液(石灰水、アンモニア水etc.)
を混ぜると、たがいの性質を打ち消す「中和」が起こります。
中和:酸性の水溶液+アルカリ性の水溶液→「塩」(えん)+水
(酸性とアルカリ性が混ざって)中和が起こると、もとの水溶液
に溶けていた物とまったく別のもの(「塩・えん」)と水ができます。
(塩(しお)ではなく「塩(えん)」です。)
*中和の例
【「塩酸」+「水酸化ナトリウム水溶液」→食塩(塩化ナトリウム)+水】
【「炭酸水」+「石灰水」→炭酸カルシウム+水】
【「硫酸」+「アンモニア水」→硫酸アンモニウム+水】
*中和反応時には【熱】が発生します。中性の時がもっとも熱を発生させます
中和の実験例

塩酸(酸性)に、水酸化ナトリウム(アルカリ性)を加えます。
BTB溶液を使って、色の変化を見ます。
「BTBさん(酸)きみど(緑)あ(青)ほ」
ですから、最初、酸性で黄色なのが、中和が起こり
緑色になります。そして、アルカリ性になると青になります。
完全中和と部分中和
中和には「完全中和」と「部分中和」があります。
「完全中和」:酸性とアルカリ性が過不足なく反応して中性の水溶液になる
「部分中和」:酸性とアルカリ性のどちらかが多いので、一部しか中和しない状態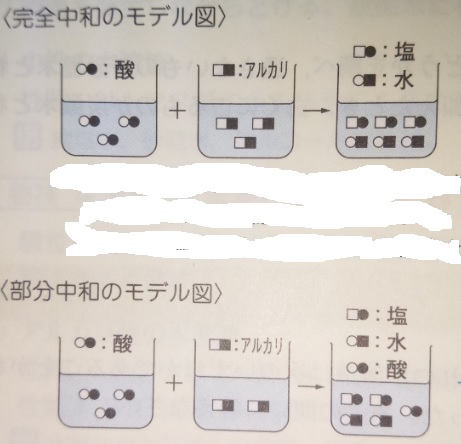
画像出典『塾技100理科』p16
上記の図の部分中和では、酸が1個残るので、(弱い)酸性の水溶液
となります。
完全中和の公式
●濃さ一定の時完全中和する水溶液の体積比は一定●
例題)塩酸100㎥Aと水酸化ナトリウム200㎥Bを混ぜると中性になります。
この水酸化ナトリウム水溶液80㎥を完全中和させるのに必要なBの塩酸の
体積はいくつですか?
例題)
1)塩酸30c㎥の水溶液Zと完全中和する水酸化ナトリウム水溶液Y
(以下「水ナト」)は40c㎥です。この時、塩酸Z45㎥を完全中和
させるのに必要な水ナトYの量はどれだけですか?
「塩酸」+「水酸化ナトリウム水溶液」→食塩+水 問題のパターン
「塩酸」+「水酸化ナトリウム水溶液」→食塩+水
になる中和反応については問題のパターンが決まっています。
●完全中和後に水溶液を蒸発させた時に残る固体の重さは?●
という問題です。
●濃さ一定の時完全中和する水溶液の体積比は一定●
これをきちんと頭に入れておきましょう。
例題)塩酸50c㎥に水酸化ナトリウム(以下「水ナト」)75c㎥を加えると、
完全に中和して中性になりました。それを蒸発させると14.5gの白い固体
ができます。
同じ塩酸と水ナトを使って、塩酸80c㎥と水ナト150c㎥を混ぜ、この混合物
から水分を蒸発させると、白い固体26.2gが残りました。
残った白い固体26.2gには、どんな物質が何g含まれているか、すべて
答えてください。
考え方)
●中和ポイントを確認する:塩酸50c㎥:水ナト75c㎥で完全中和
●完全中和の際には食塩ができる:50:70で14.5gはすべて食塩
●部分中和の場合は、多い方があまる
●濃さ一定の時完全中和する水溶液の体積比は一定
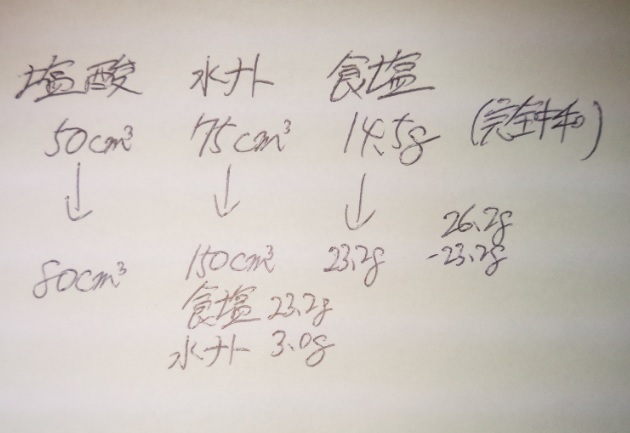
塩酸50c㎥:水ナト75c㎥で完全中和し、食塩14.5g
塩酸80c㎥と水ナト150c㎥で固体が26.2g
塩酸は8/5倍、水ナトは2倍になっているので、水ナトが多いですね?
完全中和した以降は食塩は増えませんので、
●食塩は14.5×8/5=2.9×8=23.2gが最大です
となると、残りの固体は水酸化ナトリウムという事に
なります。
26.2g-23.2g=3.0
表にして書くといいと思います。

解く際のコツは、
●完全中和のポイントを見つける
●完全中和の比率は同じ(塩酸が8/5倍なら、食塩も8/5倍)
●中和を超えたら(部分中和)それ以上食塩はできない
です。
答え)食塩23.2g、水酸化ナトリウム3g
参考:https://www.e-juken.jp/benkyo/neutralization-curry.html
図で確認してください。
▲水酸化ナトリウムに塩酸を加える→完全中和後重さは変わらない(上)
▲塩酸に水酸化ナトリウムを加える→完全中和後も重さは増える(下)
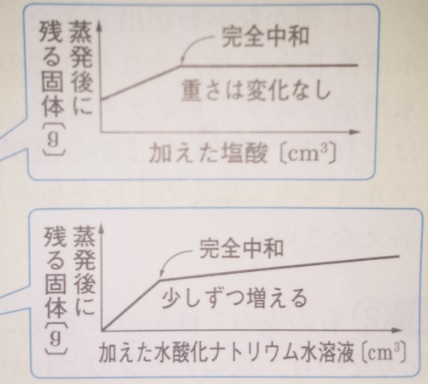
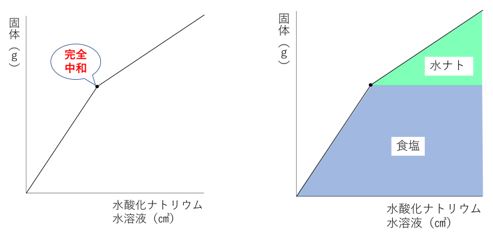
水酸化ナトリウムを加えると、完全中和後も水酸化ナトリウム分
だけ増えるというイメージです(下図)。
https://www.chugakujuken.com/koushi_blog/hashimoto/20191211.html
完全中和点を探す系の問題は「逆比」で解く
完全中和点を探す系の問題は「逆比」で解くと良いです。
例題)塩酸50㎤に様々な量の水酸化ナトリウム水溶液を加え、
A~Gのビーカーをつくりました。できた水溶液を蒸発させて
残った固体の重さを量った表が下記にあります。
塩酸50㎤を完全に中和させるのに必要な水酸化ナトリウム水溶液
の量を求めなさい。
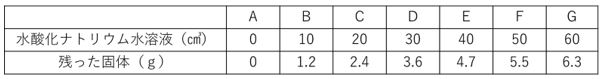
問題出典:https://www.chugakujuken.com/koushi_blog/hashimoto/20191211.html
考え方)
●濃さ一定の時完全中和する水溶液の体積比は一定●
なので、増え方の比率が一定の間は、中和が続いていて、完全中和に
向かっていると考えられます。
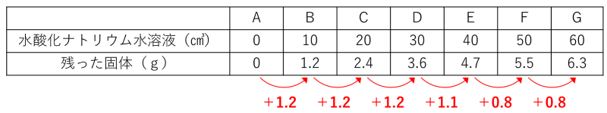
水ナトが2倍、3倍になると、残った固体も2倍、3倍になって
います。そして、「D」を最後に比率が変わっています。
残った固体の重さは増えていますが、増え方が減っています。
ですので、完全中和が終わり、食塩はもうできていなくて、
水酸化ナトリウムのみができていると考えられます。
完全中和は「D」と「E」の間ですね?
ここで「逆比」の考え方が使えます。
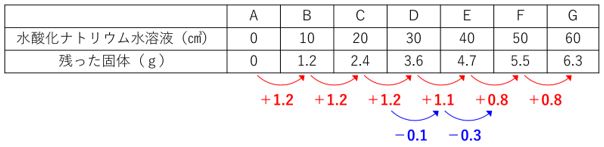
増え方の減り方(おかしい表現ですが・・・)も書き込むと
上記のようになります。
D→E、E→Fで1:3ですね?
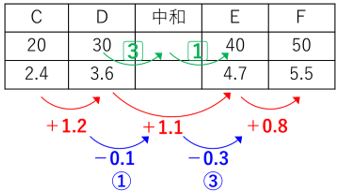
この場合、完全中和する点は、DとEの逆比3:1の点になります。
DとEの間は「10」です。それを3:1にすればいいので、
割合「1」は2.5ですね?
割合「3」のポイントは7.5ですね?
答え)37.5㎤
最初は難しいと思いますが、基本問題から始めて、徐々になれていけば
解けるのではないかと思います。
そのためには、テキスト(このブログで良いです)を読んで、たくさん
問題を解くことを繰り返してください。
水溶液の種類3つ・特徴3つ・蒸発させると?速くとかす方法3つ
水溶液(酸性・中性・アルカリ性)と指示薬(リトマス紙・BTB・フェノールフタレイン)覚え方・語呂合わせ
中和の問題パターン2つ!完全中和点を探す系の問題は「逆比」で解く